FDA 在一份新闻稿中宣布,该机构已授权 Healgen Rapid Check COVID-19/Flu A&B 抗原检测试剂盒供出现呼吸道症状的个人使用。该非处方 (OTC) 检测试剂盒是首个通过传统上市前审查途径获得营销授权的检测试剂盒,其他类似检测试剂盒目前仅在紧急使用授权 (EUA) 下可用。
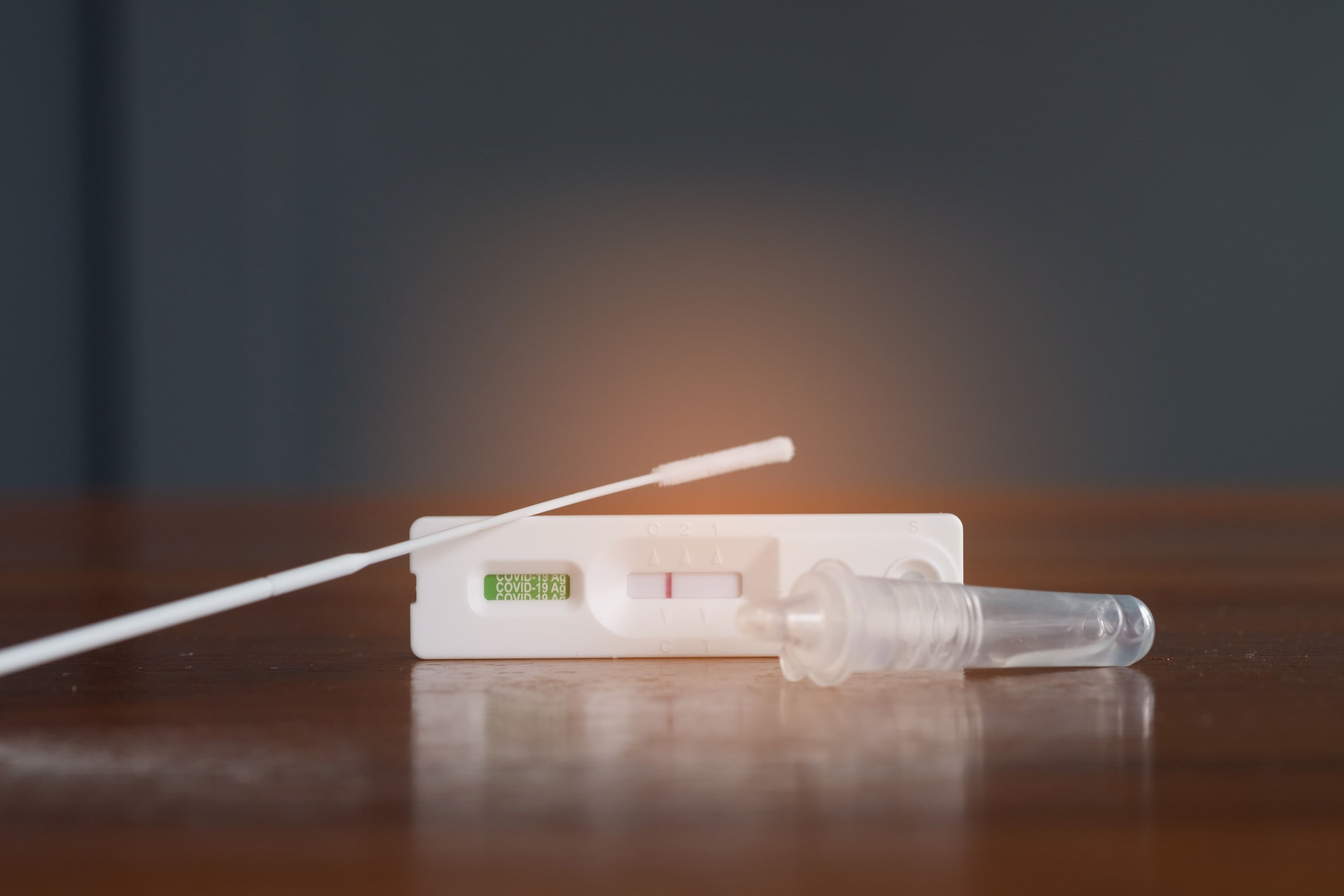
授予 De Novo 上市许可是基于一项研究的数据,该研究评估了 Healgen 快速检测对出现 COVID-19 和流感症状和体征的个体的质量、准确性和可靠性。研究发现,该检测正确识别了 99% 的阴性 SARS-CoV-2 样本和 92% 的阳性 SARS-CoV-2 样本。它还正确识别了 99.9% 的阴性流感 A 和 B 样本、92.5% 的阳性流感 A 样本和 90.5% 的阳性流感 B 样本。
FDA 设备和放射健康中心代理主任、医学博士 Michelle Tarver 在一份新闻稿中表示:“随着今年进入流感季节,许多人都担心 COVID-19 等呼吸道疾病,我们能否有效、高效地检测这些病原体将对我们的日常生活产生重大影响。”“今天的授权扩大了呼吸道症状患者在家中舒适地获取健康信息的选择。FDA 将继续采取行动,支持各种医疗状况的居家检测的开发和普及。”
Healgen Rapid Check COVID-19/流感 A&B 抗原检测获准用于 14 岁及以上的个人,或从 2 岁及以上的成人身上采集的出现呼吸道症状的个人样本。该检测旨在在症状出现后的前 5 天内使用,使用鼻拭子采集样本,通过检测 SARS-CoV-2 和甲型流感和乙型流感的蛋白质,在 15 分钟内得出结果。
FDA 在新闻稿中表示,快速抗原检测的灵敏度通常低于分子检测,这意味着存在假阴性结果的风险。如果检测结果为阴性但仍有症状,应寻求医疗保健提供者的后续治疗,因为他们可能仍患有流感、COVID-19 或其他呼吸道感染。
Healgen 首席执行官 Bingliang Fang 在一份新闻稿中表示:“我们的组合检测为个人提供了一种可靠且用户友好的解决方案,可在家中进行自我检测,从而填补了临床诊断检测中的一个关键空白。” “早期诊断可以更快地开始适当的治疗,从而改善健康状况并减少疾病传播。”
该测试的验证数据是通过独立测试评估计划 (ITAP) 收集的。该计划是美国国立卫生研究院 (NIH) 诊断技术快速加速计划的一部分,于 2021 年启动,旨在加速测试评估以支持 FDA 的监管审查,以及向公众提供准确可靠的诊断测试。
Healgen 总裁 Bryan Fang 在新闻稿中表示:“这项 De Novo 授权代表了 Healgen 的一个重要里程碑。”“凭借我们现有的最先进制造设施,我们计划扩大呼吸道测试的生产,以满足即将到来的秋季呼吸道季节的全球需求。”
参考来源:‘ FDA Authorizes Marketing of First Home Flu and COVID-19 Combination Test Outside of Emergency Use Authorities. FDA. News Release. October 7, 2024. Accessed October 8, 2024. ’
注:本文旨在介绍医药健康研究,不作任何用药依据,具体用药指引,请咨询主治医师。
(责任编辑:登越药房)




