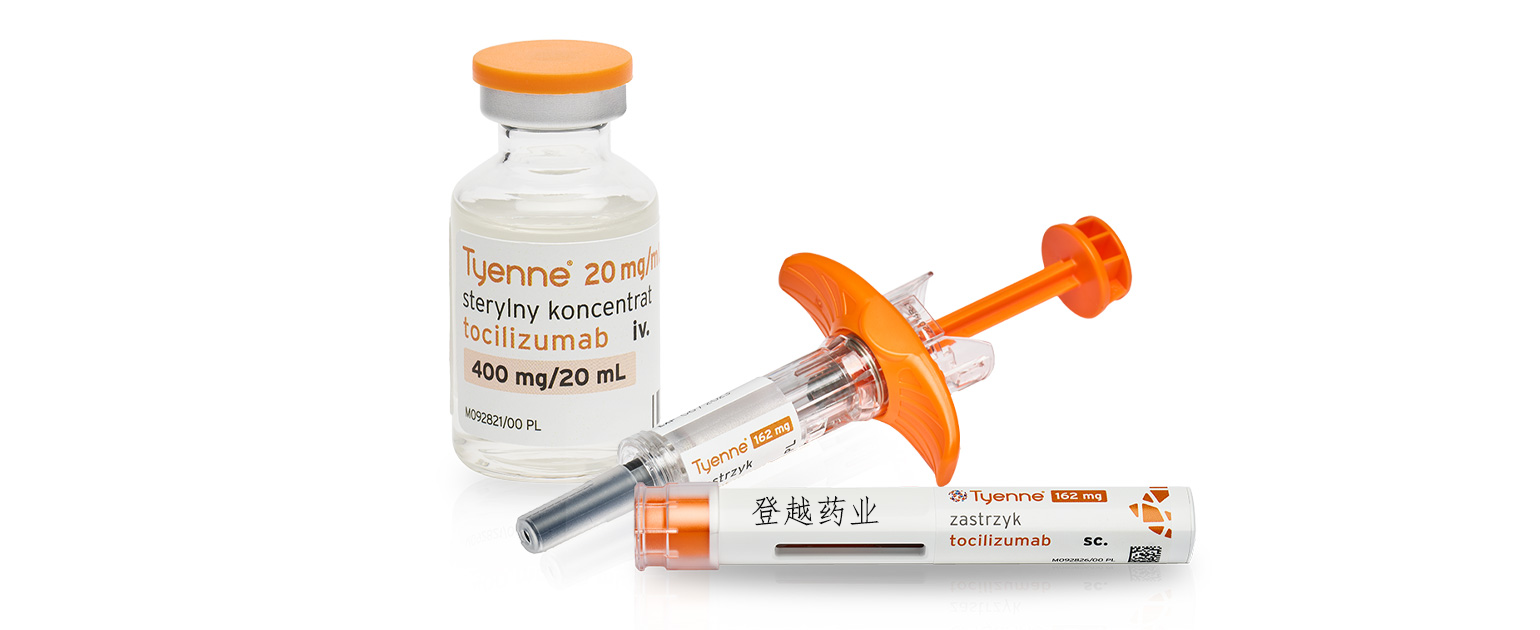
Tyenne ®(托珠单抗-aazg)是 Actemra ®(托珠单抗)的生物仿制药,除静脉(IV)给药外,目前还提供皮下(SC)制剂。
2024 年 3 月,Tyenne获得了美国食品药品管理局的批准,可根据 3 期研究的数据进行静脉和皮下给药(ClinicalTrials.gov 标识符:NCT04512001)。该试验比较了托珠单抗-aazg 与欧盟批准的托珠单抗在中度至重度活动性类风湿性关节炎患者中的效果。研究结果表明,这两种产品同样有效且安全。

Tyenne 是一种白细胞介素 6 受体拮抗剂,适用于治疗:
1.患有中度至重度活动性类风湿性关节炎的成年人,对一种或多种改善病情的抗风湿药物反应不足;
2.患有巨细胞动脉炎的成年人;
3.以及2 岁及以上患有活动性多关节型幼年特发性关节炎或活动性全身型幼年特发性关节炎的患者。
Tyenne 的作用原理是靶向并结合一种与炎症相关的蛋白质,即白细胞介素 6 (IL-6),从而抑制通过可溶性和膜结合 IL-6 受体发出的信号。这种促炎细胞因子由多种免疫系统细胞产生,包括 T 细胞和 B 细胞、淋巴细胞、单核细胞和成纤维细胞。关节中的滑膜和内皮细胞也会局部产生这种细胞因子,从而导致类风湿性关节炎等炎症。
Tyenne 是Actemra (托珠单抗)的生物仿制药,具有皮下和静脉注射两种剂型,于 2024 年 3 月 5 日获得 FDA 批准。生物仿制药是一种与参考生物制剂相似的生物制品,在安全性、纯度和效力方面没有临床意义上的差异。
皮下注射剂型有预充式注射器(162 毫克/0.9 毫升)和自动注射器(162 毫克/0.9 毫升)两种。患者在接受皮下注射技术方面的适当培训并经医疗保健提供者确认合适后,可以自行注射 Tyenne。
静脉注射剂型于2024 年 4 月推出,以溶液(80mg/4mL、200mg/10mL 和 400mg/20mL)形式提供,装在单剂量小瓶中,以便在静脉输注前进一步稀释。
参考来源:‘Fresenius continues its Biopharma Momentum with launch of subcutaneous formulation of Tyenne® (tocilizumab-aazg) in the United States. News release. July 2, 2024. ’
温馨提示:以上资讯由登越药业整理编辑(如有错漏,请帮忙指正),只为提供全球最新上市药品的资讯,帮助中国患者了解国际新药动态,仅供医护人员内部讨论,不作任何用药依据,具体用药指引,请咨询主治医师。
(责任编辑:登越药房)




