2017 年 7 月,dasiglucagon 的 III 期试验开始。 2017 年 12 月,Zealand(丹麦哥本哈根)宣布启动 dasiglucagon 的 III 期试验,并计划在 2019 年向美国食品药品监督管理局(FDA)提交积极结果。
FDA 批准达西胰高血糖素是基于两项针对患有 1 型糖尿病的成人患者(169 名参与者)的临床试验和一项针对患有 1 型糖尿病的 6 岁以上儿童患者 (31 名参与者)的临床试验的证据。
这两项试验在以下五个国家进行:美国、德国、奥地利、加拿大和斯洛文尼亚。同样的试验也用于评估达西胰高血糖素的安全性和有效性:成人试验 A 和 B 以及儿童试验 C。在所有试验中,参与者被随机分成三组:一组接受达西胰高血糖素,一组接受安慰剂,一组接受注射用胰高血糖素(一种类似的药物,FDA 批准用于与达西胰高血糖素相同的目的)。
在所有组中,参与者都接受胰岛素治疗以将血糖降至低水平(低血糖症)。受试者分别接受达西胰高血糖素、安慰剂或注射用胰高血糖素的单次注射,并评估治疗提高受试者血糖的能力。
【药理类别】
抗低血糖。
【如何供应】
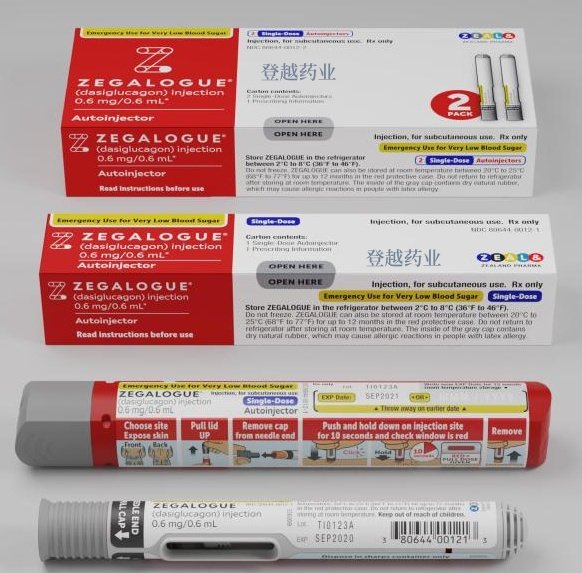
单剂量预充式注射器、单剂量自动注射器—1、2
【制造商】
新西兰制药公司
【通用可用性】
不
【作用机制】
Dasiglucagon 通过激活肝脏胰高血糖素受体来增加血糖浓度,从而刺激糖原分解和肝脏释放葡萄糖。
【Zegalogue 的用法用量】
成人和儿童
<6 岁:未确定。皮下注射至下腹部、臀部、大腿或上臂外侧。≥6 岁:0.6 毫克。如果 15 分钟后无反应,可重复。有反应后,口服碳水化合物。
【禁忌症】
嗜铬细胞瘤。胰岛素瘤。
【警告/注意事项】
指导护理人员正确使用。先前未确诊的嗜铬细胞瘤。对胰岛素瘤无效;可能导致低血糖。如果治疗后出现低血糖,请口服或静脉注射葡萄糖。肝糖原储备不足(例如饥饿、肾上腺功能不全、慢性低血糖);用葡萄糖治疗。怀孕。哺乳期母亲。
【不良反应】
恶心、呕吐、头痛、注射部位疼痛;成人还会出现:腹泻;超敏反应。
温馨提示:以上资讯由登越药业整理编辑(如有错漏,请帮忙指正),只为提供全球最新上市药品的资讯,帮助中国患者了解国际新药动态,仅供医护人员内部讨论,不作任何用药依据,具体用药指引,请咨询主治医师。
(责任编辑:登越药房)




