美国食品药品监督管理局(FDA)已接受优先审查olezarsen用于治疗家族性乳糜微粒血症综合征(FCS)成人患者的新药申请。

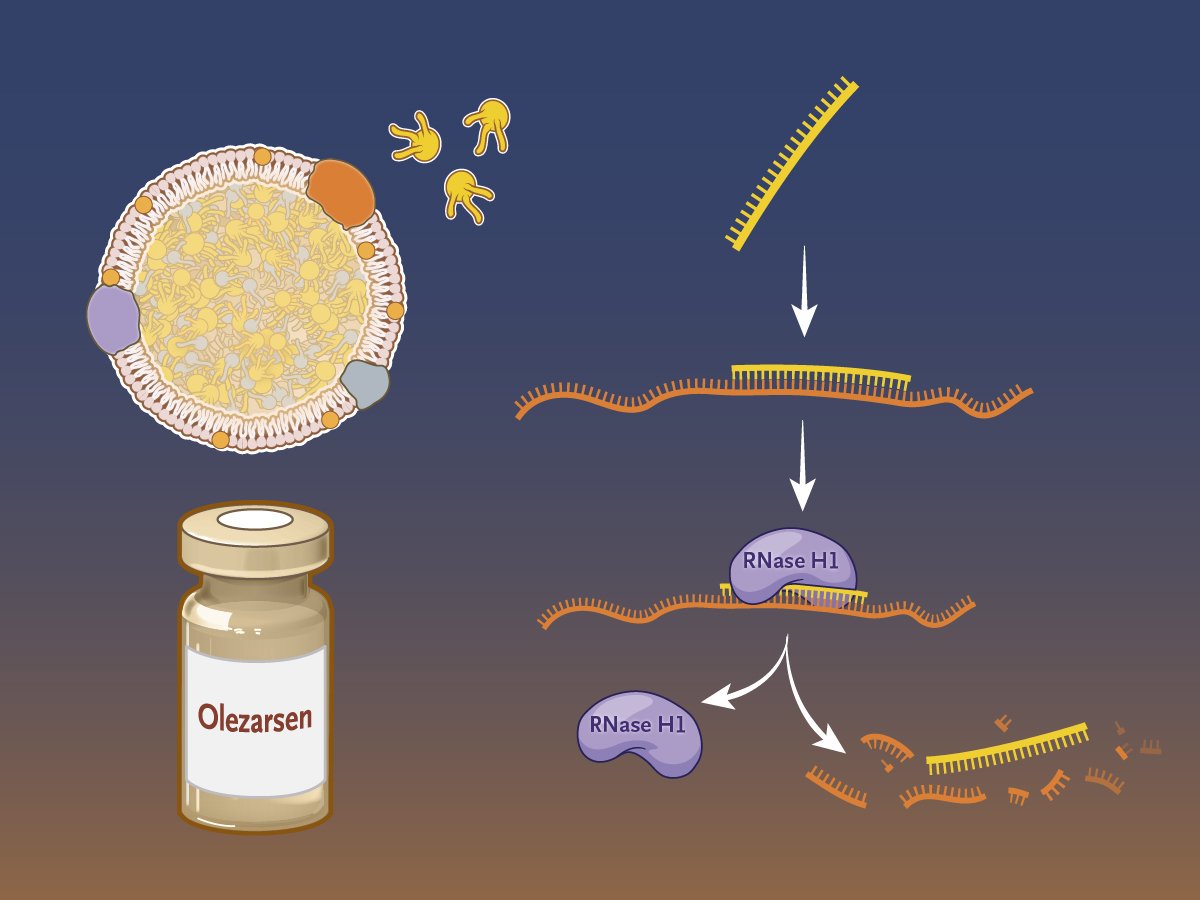
在 FCS 中,脂蛋白脂肪酶基因突变导致血浆中乳糜微粒积聚,从而导致严重的高甘油三酯血症。Olezarsen 是一种在研配体结合反义药物,旨在抑制载脂蛋白 C-III (apoC-III) 的产生,载脂蛋白 C-III 是一种在肝脏中产生的蛋白质,可调节血液中的甘油三酯代谢。
该申请得到了双盲、安慰剂对照的 3 期 BALANCE 研究(ClinicalTrials.gov 标识符:NCT04568434)的数据支持,该研究纳入了 66 名确诊为 FCS 的成年患者。研究参与者以 1:1:1 的比例随机分配,每 4 周接受一次 olezarsen 80 毫克或 50 毫克或安慰剂皮下注射,同时接受背景治疗(他汀类药物、贝特类药物、ω-3 脂肪酸)。
主要终点是 6 个月时空腹甘油三酯水平相对于基线的百分比变化。关键次要终点包括治疗期间 apoC-III 水平相对于基线的百分比变化和裁定的急性胰腺炎事件发生率。
结果显示,与安慰剂相比,6 个月后,80 毫克 olezarsen 组的甘油三酯水平显著降低(-43.5 个百分点;95% CI,-69.1,-17.9;P <.001)。50 毫克剂量的治疗在主要终点上未达到统计学意义。
与安慰剂组相比,80 毫克组和 50 毫克组的 apoC-III 水平平均变化百分比差异分别为 -73.7 个百分点(95% CI,-94.6,-52.8)和 -65.6 个百分点(95% CI,-82.6,-48.3)。截至第 53 周,每组 olezarsen 报告 1 例急性胰腺炎事件,而安慰剂组报告 11 例(比率 [汇总 olezarsen 组与安慰剂组],0.12;95% CI,0.02-0.66)。
与安慰剂组相比,80 毫克组和 50 毫克组的 apoC-III 水平平均变化百分比差异分别为 -73.7 个百分点(95% CI,-94.6,-52.8)和 -65.6 个百分点(95% CI,-82.6,-48.3)。截至第 53 周,每组 olezarsen 报告 1 例急性胰腺炎事件,而安慰剂组报告 11 例(比率 [汇总 olezarsen 组与安慰剂组],0.12;95% CI,0.02-0.66)。
预计将于 2024 年 12 月 19 日做出监管决定。FDA 此前已授予olezarsen 用于该适应症的快速通道、孤儿药和突破性疗法资格。
参考来源:‘Ionis announces olezarsen FCS New Drug Application accepted for Priority Review and enrollment in Phase 3 sHTG program completed. News release. Ionis.’
温馨提示:以上资讯由登越药业整理编辑(如有错漏,请帮忙指正),只为提供全球最新上市药品的资讯,帮助中国患者了解国际新药动态,仅供医护人员内部讨论,不作任何用药依据,具体用药指引,请咨询主治医师。
(责任编辑:登越药房)




