FDA已批准Vyvgart® Hytrulo(efgartigimod alfa 和透明质酸酶-qvfc)用于治疗患有慢性炎症性脱髓鞘性多发性神经病(CIDP)的成年人。
美国食品药物管理局(FDA)已批准 Vyvgart® Hytrulo(efgartigimod alfa 和透明质酸酶-qvfc)用于治疗患有慢性炎症性脱髓鞘性多发性神经病(CIDP)的成年人。

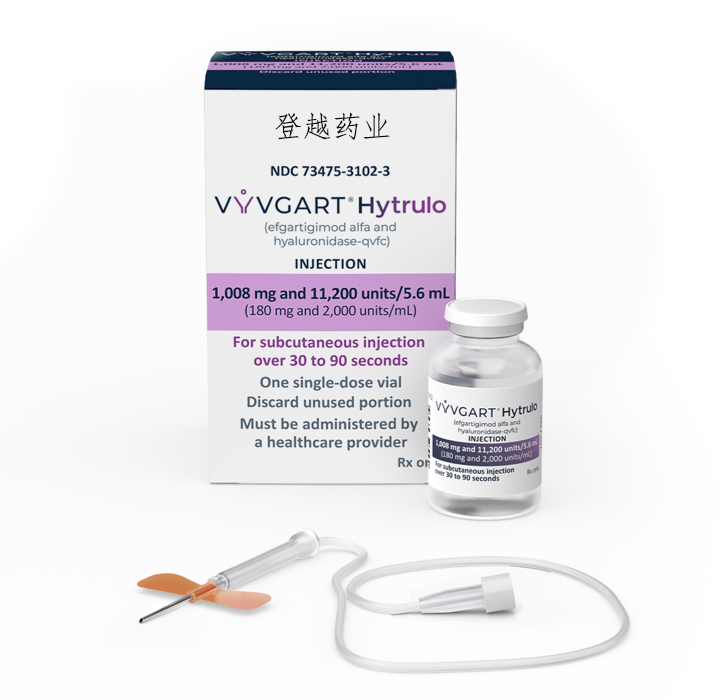
Vyvgart Hytrulo 是新生儿 Fc 受体阻滞剂 efgartigimod alfa 和内切糖苷酶透明质酸酶的组合。透明质酸酶可增加皮下 (SC) 组织的通透性,从而允许皮下注射生物制品。
此次批准基于 3 期 ADHERE 研究(ClinicalTrials.gov 标识符:NCT04281472)的数据,该研究评估了 SC 制剂对 322 名 CIDP 成人患者的疗效和安全性。该研究包括一个开放标签部分(A 阶段),其中患者每周接受一次 Vyvgart Hytrulo SC 注射,最长 12 周。A 阶段的响应者随后被随机分配接受每周一次 Vyvgart Hytrulo SC 或安慰剂,最长 48 周(B 阶段)。
在进入 B 期的 221 名响应者中,与安慰剂相比,Vyvgart Hytrulo 治疗在第 48 周将 CIDP 复发风险(定义为调整后的炎症性神经病变病因和治疗评分增加≥1 分;主要终点)降低了 61%(风险比为 0.39 [95% CI,0.25-0.61];P <.0001)。Vyvgart Hytrulo 报告的最常见不良反应是注射部位瘀伤和红斑。
Vyvgart Hytrulo 仅由医疗保健专业人员使用带翼输液器进行皮下注射。该产品以溶液形式提供,每 5.6 毫升单剂量小瓶中含有 1008 毫克 efgartigimod alfa 和 11,200 单位透明质酸酶。
Vyvgart Hytrulo 还被批准用于治疗抗乙酰胆碱受体抗体阳性的成年全身性重症肌无力患者。
参考来源:‘argenx announces FDA approval of Vyvgart Hytrulo for chronic inflammatory demyelinating polyneuropathy. News release. Argenx. June 21, 2024.’
温馨提示:以上资讯由登越药业整理编辑(如有错漏,请帮忙指正),只为提供全球最新上市药品的资讯,帮助中国患者了解国际新药动态,仅供医护人员内部讨论,不作任何用药依据,具体用药指引,请咨询主治医师。
(责任编辑:登越药房)




