FDA已批准静脉注射免疫球蛋白human-dira(Yimmugo;Biotest AG)用于治疗原发性免疫缺陷(PID)患者。创新的静脉注射免疫球蛋白(IVIG)是Biotest产品组合中第一个获FDA批准的产品。
美国食品药品管理局(FDA)已批准静脉注射免疫球蛋白 human-dira (Yimmugo; Biotest AG) 用于治疗原发性免疫缺陷 (PID) 患者。创新的静脉注射免疫球蛋白 (IVIG) 是 Biotest 产品组合中第一个获得 FDA 批准的产品。


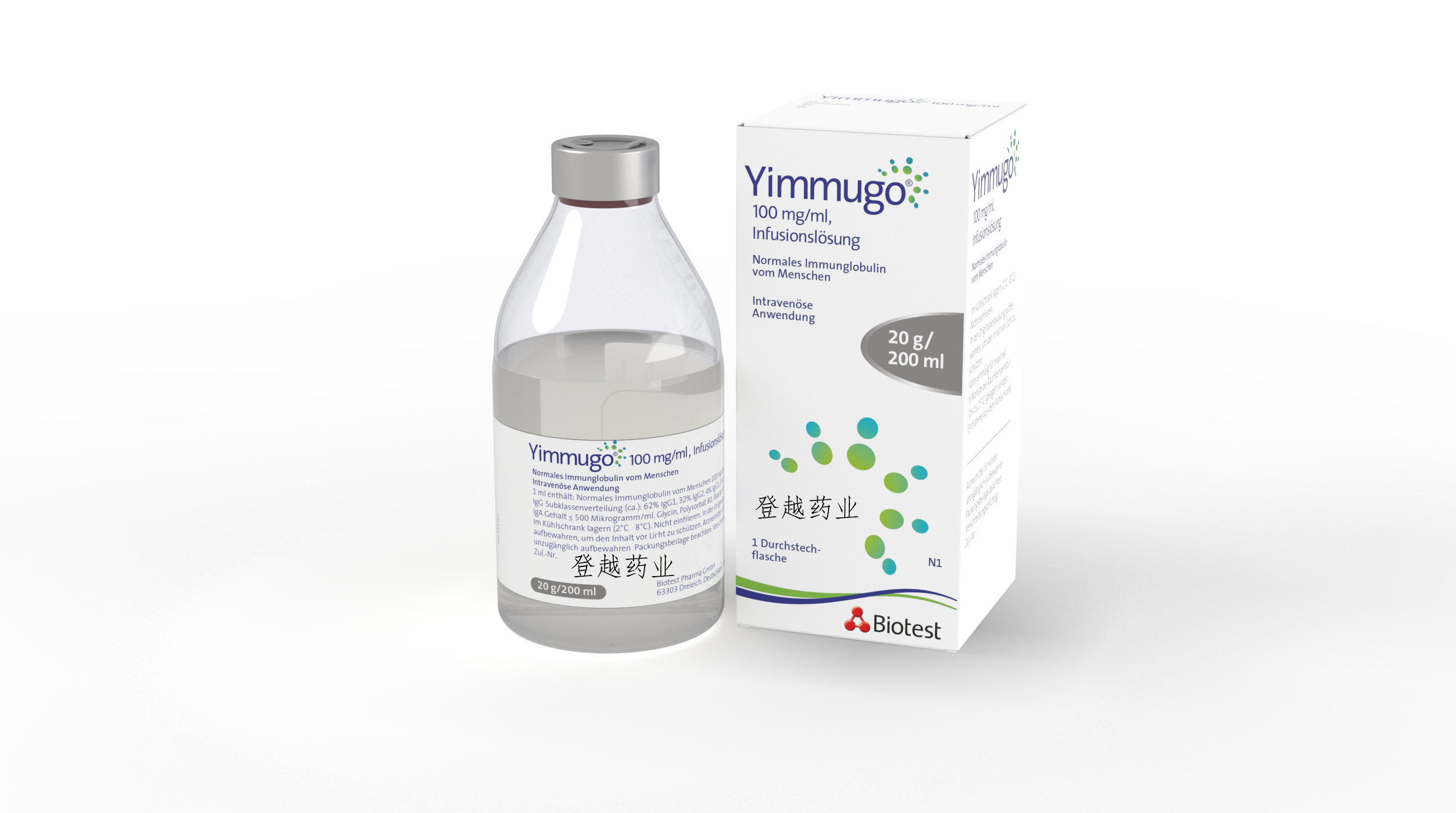
Yimmugo 由健康志愿者血浆制成,可提供针对各种感染因子的广谱浓缩多克隆免疫球蛋白 G (IgG) 抗体。该产品采用冷乙醇分馏、辛酸沉淀以及阴离子和阳离子交换色谱法相结合的方式制造。
此次批准基于一项开放标签、前瞻性、3 期研究(ClinicalTrials.gov 标识符:NCT02810444)的数据,该研究评估了 Yimmugo 对 67 名PI患者(平均年龄 35 岁)的疗效和安全性,这些患者已接受至少 3 个月的恒定剂量免疫球蛋白静脉注射治疗,并且在之前 3 个月内至少有一次 IgG 谷水平至少为 5g/L。
研究参与者每 3 或 4 周接受 Yimmugo 0.2 至 0.8g/kg 体重治疗,持续 12 个月。主要终点是 12 个月期间严重细菌感染 (SBI) 的发生率,SBI 定义为细菌性肺炎、菌血症/败血症、骨髓炎/化脓性关节炎、内脏脓肿或细菌性脑膜炎。
报告称,在 12 个月的研究期间,急性 SBI 发生率为 0.07,符合预定的成功率,即每名患者每年急性 SBI 发生率低于 1 次。五名患者经历了急性 SBI(所有 5 次发作均为细菌性肺炎)。
治疗中观察到的最常见不良反应是头痛、上呼吸道感染、疲劳、恶心和血压升高。
Yimmugo 以单剂量小瓶形式供应,为含有 10% IgG(100mg/mL)的溶液,包装如下:5g/50mL;10g/100mL;20g/200mL。该产品预计将于 2024 年下半年上市。

参考来源:‘Grifols’ Biotest receives FDA approval for innovative Yimmugo® immunoglobulin to treat primary immunodeficiencies. News release. Grifols. June 17, 2024.’
温馨提示:以上资讯由登越药业整理编辑(如有错漏,请帮忙指正),只为提供全球最新上市药品的资讯,帮助中国患者了解国际新药动态,仅供医护人员内部讨论,不作任何用药依据,具体用药指引,请咨询主治医师。
(责任编辑:登越药房)




