2024年5月16日讯/香港登越药业Dengyue/--新泽西州沃伦 - PTC Therapeutics, Inc.(纳斯达克股票代码:NASDAQ:PTCT)5月14日宣布,其 Upstaza™ (eladocagene exuparvovec) 的生物制剂许可申请 (BLA) 已被美国
2024年5月16日讯/香港登越药业Dengyue/--新泽西州沃伦 - PTC Therapeutics, Inc.(纳斯达克股票代码:NASDAQ:PTCT)5月14日宣布,其 Upstaza™ (eladocagene exuparvovec) 的生物制剂许可申请 (BLA) 已被美国食品和药物管理局 (FDA) 接受并获得批准优先审查。Upstaza 是一种用于治疗芳香族 L-氨基酸脱羧酶(AADC)缺乏症的基因疗法候选药物,其 PDUFA 目标行动日期定为 2024 年 11 月 13 日。

关于 Upstaza ™ (eladocagene exuparvovec)
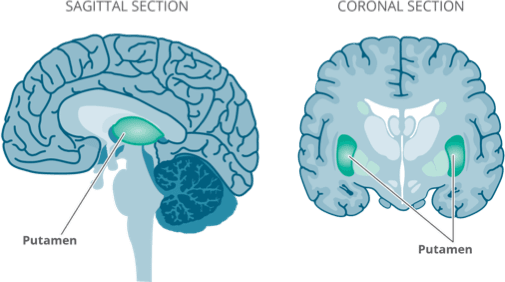
Upstaza 是一种一次性基因替代疗法,适用于治疗 18 个月及以上、经临床、分子和遗传学确诊患有芳香族 L-氨基酸脱羧酶 (AADC) 缺乏症的患者。严重的表型。它是一种基于重组腺相关病毒血清型 2 (AAV2) 的基因疗法,含有人类DDC基因。它旨在通过提供功能性基因来纠正潜在的遗传缺陷DDC基因直接进入壳核,增加 AADC 酶并恢复多巴胺的产生。
Upstaza 的功效和安全性已在临床试验和同情使用计划中得到证实。第一位患者于 2010 年接受给药。在临床试验中,Upstaza 表现出转化性神经系统改善。最常见的副作用是最初的失眠、烦躁和运动障碍。
Upstaza 管理通过立体定向外科手术进行,这是一种微创神经外科手术,用于治疗许多儿童和成人神经系统疾病。 Upstaza 管理程序由立体定向神经外科专业中心的合格神经外科医生执行。
BLA得到了临床试验和同情性使用项目的疗效和安全性数据的支持,这些数据证明了AADC缺陷症患者的神经功能改善。一项长期研究的结果显示,在超过5年的随访中,运动和认知功能得到了快速改善。
PTC Therapeutics首席执行官、医学博士Matthew B. Klein表示:“我们很高兴能够向美国AADC缺陷症患者提供获得批准的疗法又迈进了一步。“迄今为止收集的数据继续支持Upstaza的变革性好处,这是一种直接注入大脑的高度创新的基因疗法。”
参考来源:PTC Therapeutics announces FDA acceptance and Priority Review of the BLA for Upstaza. News release. PTC Therapeutics. May 14, 2024.
注:本文旨在介绍医药健康研究,不作任何用药依据,具体用药指引,请咨询主治医师。
(责任编辑:登越药房)




