202 4 年4月 19 日讯 /香港登越药业Dengyue/ --FDA 已批准第一三共制药的 Vanflyta(quizartinib)用于治疗新诊断的急性髓系白血病(AML)成人患者。它适用于与标准阿糖胞苷和蒽环类药物诱导以
2024年4月19日讯 /香港登越药业Dengyue/ --FDA 已批准第一三共制药的 Vanflyta(quizartinib)用于治疗新诊断的急性髓系白血病(AML)成人患者。它适用于与标准阿糖胞苷和蒽环类药物诱导以及阿糖胞苷巩固联合使用,并作为巩固化疗后的维持单药治疗。 Vanflyta 是FLT3的口服抑制剂,它专门针对FLT3 -ITD 突变,这种突变会促进癌症生长并导致复发风险增加和总生存期缩短。
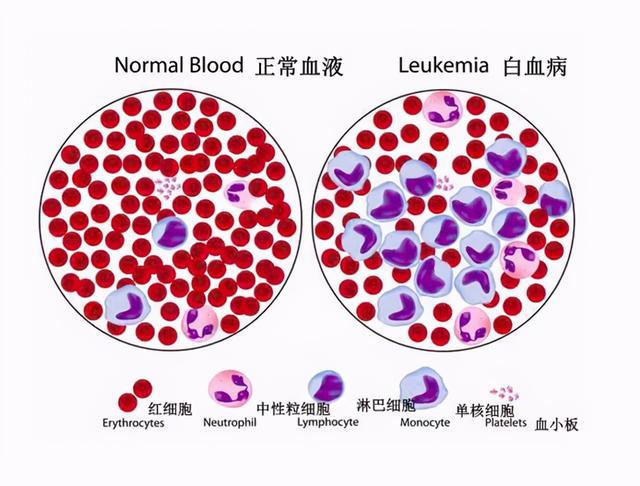
AML 是成人中最常见的白血病形式之一,高达 37% 的新诊断 AML 患者存在 FLT3 基因( FMS 样酪氨酸)突变激酶3)。其中约 80% 是FLT3 -ITD 突变。
作用机制
Quizartinib 是受体酪氨酸激酶 FLT3 的小分子抑制剂。 Quizartinib 及其活性代谢物 AC886 抑制 FLT3 激酶活性,防止受体自身磷酸化,从而抑制下游 FLT3 受体信号传导并阻断 FLT3-ITD 依赖性细胞增殖。
适应症
与标准阿糖胞苷和蒽环类药物诱导以及阿糖胞苷巩固结合,并作为巩固化疗后的维持单药治疗,用于治疗新诊断的急性髓系白血病 (AML) 成人,该患者经 FLT3 内部串联重复 (ITD) 检测呈阳性。 FDA 批准的测试。
使用限制
不适用于同种异体造血干细胞移植 (HSCT) 后的维持单一治疗。
VANFLYTA剂量和给药方法(成人)
确认 FLT3-ITD 突变阳性的存在。整个吞下。每天在同一时间服用。诱导:从第8天开始每天一次35.4mg(对于7+3方案),每个周期(第8-21天)持续2周,最多2个周期或直到疾病进展或不可接受的毒性。对于(5+2 方案)作为第二个诱导周期,在第 6-19 天给药。巩固治疗:从第 6 天开始每天一次 35.4mg,每个周期(第 6-19 天)持续 2 周,最多 4 个周期或直至疾病进展或出现不可接受的毒性。维持:如果 QTcF ≤ 450 毫秒,第 1-14 天每天一次 26.5 毫克;如果 QTcF ≤ 450 毫秒,则在第一个周期的第 15 天增加至每天一次 53 毫克。如果在诱导或传导过程中观察到 QTcF >500ms,则维持 26.5mg 每日一次。每日一次,周期之间不间断,最多 36 个周期,或直至疾病进展或出现不可接受的毒性。进行 HSCT:在预处理方案开始前 7 天停止治疗。剂量修改:参见完整标签。
注:本文旨在介绍药品健康研究分享,不作任何用药依据,具体用药指引,请咨询主治医师。
(责任编辑:登越药房)




