Efgartigimod alfa 注射剂 (Vyvgart; argenx) 最初于 2021 年获得 FDA 批准,是一种新生儿 Fc 受体阻滞剂,用于治疗抗乙酰胆碱受体 (AChR) 抗体阳性的成人患者的全身性重症肌无力。Efgartigimod alfa 是一种人类 IgG1 抗体片段,可与新生儿 Fc 受体结合,导致体内循环 IgG 水平降低。

此项批准基于 2021 年 7 月发表在《柳叶刀神经病学》上的全球 3 期 ADAPT 试验的结果。该试验达到了其主要终点,表明与安慰剂相比,使用 efgartigimod alfa 治疗后,抗 AChR 抗体阳性的全身性重症肌无力患者在 MG-ADL 量表上有反应的人数明显增多(68% vs 30%;p<0.0001)。有反应者的定义是,在第一个治疗周期内,MG-ADL 量表至少减少 2 分,并且持续 4 周或更长时间。
这种药物是输液剂型,建议剂量为 10 mg/kg,静脉注射,给药时间为 1 小时。通常每周给药一次,持续 4 周。对于体重 120 公斤或以上的患者,建议剂量为每次输液 1200 mg。由于这种药物是输液剂,因此应通过 0.2 微米在线过滤器用 0.9% 氯化钠注射液稀释。该药物以 400 mg 20ml 或 20 mg/ml 单剂量小瓶形式提供。
对于有活动性感染的患者,应推迟使用依加替莫德阿尔法治疗。出现输液反应的患者应在下次服药前接受评估,出现严重超敏反应的患者应避免用药或密切监测(如果医生建议下次服药)。依加替莫德阿尔法最常见的不良反应包括呼吸道感染、头痛和泌尿道感染。
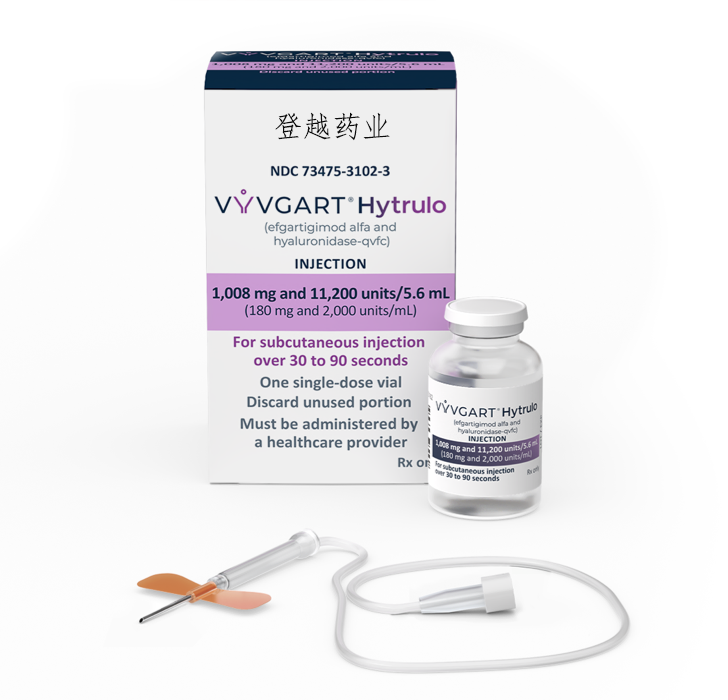
FDA 还批准了 efgartigimod alfa 和透明质酸酶 (Vyvgart Hytrulo; argenx) 的复合制剂。透明质酸酶可增加皮下组织的通透性,是一种内切糖苷酶。该制剂适用于治疗抗乙酰胆碱受体抗体阳性的全身性重症肌无力成人患者,以及慢性炎症性脱髓鞘性多发性神经病 (CIDP) 。
依加替莫德 α 和透明质酸酶的剂量为 1008 毫克/11,200 单位,每周注射一次,共注射 4 周。根据个人需求,剂量和给药途径可能因患者而异。依加替莫德 α 和透明质酸酶最常见的一些不良反应是注射部位反应、皮疹、红斑、瘙痒、瘀伤、疼痛、荨麻疹、头痛和尿路感染。3重要的是,依加替莫德 α 通过输液给药,而依加替莫德 α 和透明质酸酶由医疗保健专业人员通过皮下注射给药。
药剂师可以为接受这两种治疗的患者提供额外的资源,包括解释患者的治疗方案、治疗过程以及患者可以期待什么。还有其他自学资源,例如 My Vyvgart path,可以帮助患者了解保险流程。这些资源可以帮助填补常规健康保险可能无法覆盖的财务缺口,以应对需要 Vyvgart 的患者。
有了这些针对 AchR 抗体阳性重症肌无力和 CIDP 患者的新治疗方案,患者有了更多选择。重要的是,这些治疗还可以根据患者的需求和偏好进行个性化(输液或注射)。
参考来源:‘ argenx Announces US Food and Drug Administration (FDA) Approval of Vyvgart (efgartigimod alfa-fcab) in Generalized Myasthenia Gravis. Business Wire. December 17, 2021. Accessed August 28, 2024.’
温馨提示:以上资讯由登越药业整理编辑(如有错漏,请帮忙指正),只为提供全球最新上市药品的资讯,帮助中国患者了解国际新药动态,仅供医护人员内部讨论,不作任何用药依据,具体用药指引,请咨询主治医师。
(责任编辑:登越药房)




